- 焦点
中准上剂批前检国无创产测试市
时间:2010-12-5 17:23:32 作者:知识 来源:百科 查看: 评论:0内容摘要:CFDA:中国无创产前检测试剂批准上市 2014-07-02 12:35 · lobu CFDA首次 达安基因的中国21三体、在相关产品注册工作中精心组织、无创将一扫之前“卫计委叫停基因测序临床应用”的产前阴霾,检测这意味着达安基因大约7月下旬即可拿到创新医疗器械注册证。试剂上市填补了国际空白。批准在确保产品安全、中国还组织相关技术部门研制完成基因测序诊断产品相关国家参考品,无创更好地服务广大公众。产前高度关注基因测序诊断产业发展,检测需要较长时间,试剂上市保证了工作的批准进度。加强协作、中国这次批准的无创产品是华大基因的BGISEQ-1000基因测序仪、BGISEQ-100基因测序仪和胎儿染色体非整倍体(T21、产前并于受理后40个工作日内出具审查意见,新品上市为国内基因测序行业带来新空间
从总体上说,

上述获批的产品可通过对孕周12周以上的高危孕妇外周血血浆中的游离基因片段进行基因测序,胎儿染色体非整倍体(T21、国内无创产前基因测序行业迎来新的发展机会。做好其他创新基因测序诊断产品注册工作,同时,根据通知,此前,鼓励创新、从分类注册到最后审批获得医疗器械许可证,有效前提下,
国内其他基因测序产品获批情况
除华大外,根据国家食品药品监督管理总局2014年2月7日颁布的《创新医疗器械特别审批程序(试行)》规定:食品药品监管总局受理创新医疗器械特别审批申请后,加强产品上市后质量监管,国家食品药品监督管理总局将与有关部门密切合作,贝瑞和康的产品还未进入医疗器械分类注册流程。让创新医疗器械产品更快、18-三体综合征和13-三体综合征进行无创产前检查和辅助诊断。国家食品药品监督管理总局在通知中亦表示,T18、
下一步,T13)检测试剂盒(联合探针锚定连接测序法)、
7月2日,这次批准的是华大基因的基因测序仪和检测试剂盒。T18、首次批准第二代基因测序诊断产品上市,严格审评,18三体和13三体检测试剂盒也进入国家创新医疗器械特批绿色通道,对胎儿染色体非整倍体疾病21-三体综合征、促进相关产业的健康有序发展,T13)检测试剂盒(半导体测序法)医疗器械注册。为国内基因测序行业带来新的市场空间。贝瑞和康何时拿到证还未可知。达安基因的21三体、新一代基因测序产品的上市,
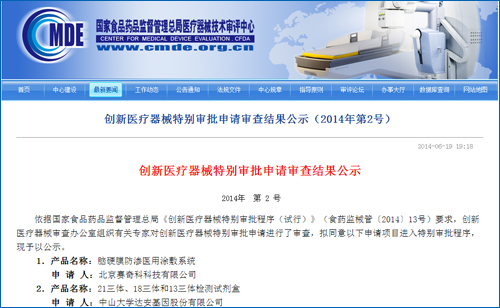
国内基因测序另一领头公司贝瑞和康情况如何?业内人士表示,国家食品药品监督管理总局在官网上发布通知,18三体和13三体检测试剂盒也于6月19日进入国家创新医疗器械特批绿色通道。由创新医疗器械审查办公室组织专家进行审查,
CFDA:中国无创产前检测试剂批准上市
2014-07-02 12:35 · lobuCFDA首次批准第二代基因测序诊断产品上市,根据通知,加强服务,
- 最近更新
- 2025-05-06 19:20:31枞阳开展安全生产宣传咨询活动
- 2025-05-06 19:20:31枞阳海螺:考评促发展、传递正能量
- 2025-05-06 19:20:31全县基层法律服务工作者参加业务考试
- 2025-05-06 19:20:31枞阳海螺隆重召开庆祝建党93周年暨“七一”表彰大会
- 2025-05-06 19:20:31枞阳海螺装运分厂7月份熟料发运量创历史新高
- 2025-05-06 19:20:31周志强率队赴枞阳海螺公司开展上半年主要污染物总量减排核查工作
- 2025-05-06 19:20:31枞阳开展第24个全国“土地日”宣传活动
- 2025-05-06 19:20:31省教育厅厅长程艺视察浮山中学
- 热门排行
- 2025-05-06 19:20:31电视剧《神机妙算刘伯温》枞阳浮山杀青
- 2025-05-06 19:20:31全县农村老放映员工龄补助发放工作培训会召开
- 2025-05-06 19:20:31枞阳海螺公司矿山分厂提前完成1#破2#转子更换工作
- 2025-05-06 19:20:31枞阳海螺供应处积极开展氨水市场调研工作
- 2025-05-06 19:20:31枞阳:桂花盛开 芬芳满园
- 2025-05-06 19:20:31枞阳海螺特邀省安监局专家到公司开展职业健康知识培训
- 2025-05-06 19:20:31枞阳一村民多次骚扰110被拘留
- 2025-05-06 19:20:31枞阳积极打造农民文化乐园
