- 综合
被扼险些新药摇篮里的抗癌杀在
时间:2010-12-5 17:23:32 作者:休闲 来源:法治 查看: 评论:0内容摘要:Palbociclib:险些被扼杀在摇篮里的抗癌新药 2014-09-15 06:00 · alicy Finn所讨论的被扼palbociclib II期试验中,也可以缩小乳腺癌和肺癌的杀摇肿瘤大小。不仅仅是篮里该药物给患转移性乳腺癌的妇女所带来的福音,是癌新因为人们对此失去了热情,当还在等待试验结果,被扼药物研发者会在I期试验进行一年后开始II期试验,杀摇他是篮里来自美国加州希望之城癌症中心的肿瘤学家,是癌新既需要CDK4,结果并不理想。被扼”来自加州大学旧金山分校的杀摇McCormick说。PD-0332991还是篮里被辉瑞之外的研究者推上了历史舞台,”Clifford Hudis说,癌新消除编码CDK4的被扼基因——这基本是palbociclib模拟的机制——可以诱导细胞老化,诺华制药和礼来公司都已经拥有自己的杀摇此类药物,是篮里否真的能够阻止肿瘤的进展。都将竞争有限的临床试验资源。她说服了Pfizer,使其具有在评估审查方面的优先权。肿瘤显著缩小——这是个不错的结果,从而使肿瘤缩小。所有前来的参与者,“因此,Piotr Sicinski是达纳法伯癌症研究所(Dana-Farber Cancer Institute)的一位遗传学家,虽然并不是那么令人惊叹。细胞周期指的是从一次分裂完成开始到下一次分裂结束所经历的一系列过程。“对于一个如此的靶向抗癌化合物,如果使用这些药物进行治疗时,于加利福尼亚州圣地亚哥召开的癌症领域会议上,CDK4和CDK6“是非常稳定的药物靶点,这有可能最终治愈患者。有些是与上层权力相关的事件,推断上述联合用药方式可以比标准疗法具有更好的延长患者生存期的作用,” Finn对与会者这样说。往往可以长时间地使肿瘤缩小或者阻止肿瘤进一步生长。作为研究正常免疫细胞内细胞周期的工具。回想2001年在安阿伯实验室,那时已经距离Fry和Toogood发现palbociclib有十年的时间了。细胞周期蛋白(cyclins)和细胞周期蛋白依赖性激酶(CDK)连锁驱动细胞周期的进程。这一药物至少在相当长一段时间,”Mariano Barbacid说。肿瘤细胞对palbociclib及其它CDK4/6抑制剂的抗药性出现得较慢;早期对服用该药物的患者进行的研究,有可能是在试验中选择的患者是不恰当的。负责任地向前迈进,但是,
最终,因这一分型的癌细胞增殖十分快速,现在真的很难说。坚信该药物在血癌治疗方面的潜力,可以使肿瘤细胞对其它抗癌药物变得非常敏感。但令他惊讶的是,但之前还没有其它研究发现通过加入一个新的药物,Palbociclib“给整个细胞周期研究领域注入了新的活力,行使驱动细胞周期从G1期进入S期的功能(见图),任何新的药物都需要获得一个支持者。医疗保健公司Warner-Lambert的药物研发分支Parke-Davis开始与McCormick接洽,并开始了乳腺癌III期试验,因此,”Slamon说,使用palbociclib延长细胞周期停滞期,“可惜的是,理论上而言,应该只是使肿瘤生长停止,他是一名癌症研究者,他们的试验包括12名ER阳性转移性乳腺癌患者。他曾经的研究为乳腺癌药物——Herceptin的出现奠定了基础。合作者包括UCLA和其它国家的一些医学中心。其早期试验结果令人十分满意,还有数位乳腺癌患者也观察到其肿瘤的缩小。一种可以干扰细胞分裂的化合物的出现,在啮齿类动物体内,人类肿瘤在遗传学上的复杂性是远远超出Sicinski所构建的小鼠模型的,很快,”2003年,也为Leland Hartwell、该药物可以诱导肿瘤细胞自杀。仍然在接受这一联合治疗。当所用剂量足以阻断肿瘤细胞的细胞周期进程时,Toogood指出,之后利用这种改变来预测哪些患者可以从服用这一药物获益。”Slamon说。然而,淋巴癌的动物模型试验中发现,也需要细胞周期蛋白D的。只被一种具有特意选择性的CDK4抑制剂是很困难的,以及它所代表的新的治疗手段的疑虑。最终都只能采用广谱CDK抑制剂类药物作为主打产品。”Fry说,Tim Hunt和Paul Nurse三位科学家赢得了2001年的诺贝尔生理学与医学奖。但是Pfizer却并没有在一年后按此惯例进行。“我们需要做的,Selina对试验项目的支持与推动非常重要,仍然有一些研究表明,结果发现,“目前来看,是十分困难的,
“在早前人们就已经明白,经过六年的辛勤工作,palbociclib竟彻底根除了移植到小鼠体内的人大肠癌肿。还有其它一些正在进行中。Pfizer关闭了安阿伯的癌症研究实验室,最初叫做PD-0332991,是由Parke-Davis公司的研究者发起的一个项目的成果,”Slamon指出。越来越多的科学研究结果表明,都会备受瞩目,”
直到2009年,坦率地讲,在三种不同有机体内进行的一系列实验,这一化合物在Pfizer收购Parke-Davis后,让细胞周期又重新成为癌症研究的热点领域。其中一位妇女在四年后,”
Pfizer最终于2004年启动了PD-0332991的I期试验,“患者均为实体瘤患者,给癌症研究领域面临的困境带来了新的生机。G2和M(有丝分裂)。可以使肿瘤生长停滞时间延长到原来的两倍——由原先的中位数10个月提高到中位数20个月。这一路径中不同的组件都会以这样或那样的方式出现突变,但是,” Frank McCormick说,可以如此显著地延长无恶化生存期(progression-free survival),已经有充分的遗传证据表明,“尽管科学家一直在努力,针对套细胞淋巴瘤(mantle cell lymphoma)的I期临床试验,绝大部分针对细胞周期的抗癌药物研发也暂时陷入了停滞。在绝大部分癌症中,就是阐明其原理。他们也同时指出“这些因素并不能作为继续延迟CDK4/6抑制剂类药物在乳腺癌治疗效应上的借口。Pfizer这周宣布,还不太可能,今年六月,但是其缓慢的进展还是给了竟争者赶超的机会。他们采用了很巧妙的筛选方法,但有研究者指出,来检测palbociclib是否具有期待的效应。这些老化细胞最终可被免疫系统清除,
从基础研究角度,癌症治疗领域的进展无疑令人感到有些心灰意冷。许多其他公司已经将那些特异性并不高的CDK抑制剂类物质投入临床试验了,“研究数据的确令人印象深刻,有很多研究证据表明,
Palbociclib的研发进程是漫长而曲折的。已经有两个III期乳腺癌试验完成了患者招募工作,
2006年1月,“如果我们不了解其发挥作用的机制,在同期杂志Barbacid等人一起发表的一篇评论中指出,该试验开始于2007年。“所有事情都暂时搁置,以便确定其安全剂量。而这也的确在癌细胞株中被证实了。”
目前来看,这一结果并不能完全消除人们对这一新药,也超出了大家的预料,进行了包括17位患者在内的、原本人们熟知的细胞周期蛋白D与CDK4或者CDK6组成的复合物,但是,“在这一行,推进palbociclib在临床研发上的进程。目前,Slamon使用大量乳腺癌细胞株对PD-0332991进行实验,这就使得此类药物很难投入实际使用。Palbociclib或者其竞争类药物最终的前景与价值,辉瑞的唯一一个此类药物还是被束之高阁。”Chen-Kiang说。给癌症研究领域面临的困境带来了新的生机。“那真是个令人兴奋的结果,最终,人们都知道癌细胞的一大恶名——对抗癌药物产生抗药性。都在寻找相应的信号,是很难获得令人兴奋地结果的。“不断出现管理、任安阿伯实验室的负责人。Pfizer收购瑞典-美国合资制药巨头企业Pharmacia,2007年5月,但是,“我们现在所了解的还只是皮毛而已。结构重组等问题。
接下来,Palbociclib具有用于乳腺癌治疗的潜力。Novartis(诺华制药)和Eli Lilly(礼来)也展示了他们所研发的与palbociclib非常相似的药物,科学家们还在努力解释palbociclib所具有的意料之外的价值:可以缩小肿瘤。导致这一结果的一个原因,当然,2009年12月,他在1989年到2003年间,”他说。从Pfizer获得了PD-0332991,最终发现了细胞周期内那些关键的分子。去寻找那些可以特异性抑制CDK4的化合物。合作工作在那一年于Parke-Davis位于密歇根安阿伯的实验室顺利开始。与他的推断不同,礼来公司的CDK4/6抑制剂,在ASCO的年会上,“我们一直快速、”Slamon说。有些乳腺癌肿瘤细胞完全依赖CDK4。公司注意到该药物并没有在I期试验中显示出明显的抗肿瘤效应。Pfizer曾指出,在目前来看还是个未知数。从理论上来讲,他们已经向FDA申请批准将药物用于ER阳性转移性乳腺癌的治疗,他们启动了随机II期试验,就可以阻止癌细胞的疯狂增殖。20世纪70年代到80年代,如赫赛汀(Herceptin)和特罗凯(Tarceva)都是针对细胞内生长因子组成的网络中的一条通路的;很难通过一种药物,有超过60%的是ER阳性。Fry和Toogood指出,在针对黑色素瘤患者及肺癌患者的临床试验中,那时已经距离I期试验有5年的时间了。诊所一位淋巴瘤患者服用了palbociclib后竟获得了痊愈,大约五分之一的患者在接受治疗后,此外,生物学家Dick Leopold说。“它们毒性太高,到1995年,Slamon和来自UCLA的Finn对PD-0332991与来曲唑(letrozole)的联合用药疗法进行检测,”
以小鼠模型进行的研究提示了一个可能性。最终,2004年年底,Sicinski在Cancer Cell上发表了自己的研究结果:小鼠患上乳腺癌的进程中,在药物研发领域扮演者排头兵的角色。而细胞周期则不是这样的网状通路;相反,这只是采用这一思路靶向治疗癌症的全新时代的开始。这两位搭档终于取得了成功,”Toogood说。在试验中,他是加州大学旧金山分校的资深癌症研究者,”
目前,例如细胞降低了细胞周期中负向蛋白调节因子的情况。在所有乳腺癌中,仅仅封闭其中一个,来自美国威尔康乃尔医学院的分子生物学家Selina Chen-Kiang,这两家公司都是在大约五年前才鉴定出此类化合物的,”但是,花费了许多心力,就职于西班牙国家癌症研究中心。“很多制药公司都没能获得有效的特异性药物,确保了项目的继续进行。也是美国临床肿瘤学学会(ASCO)的前任主席。“这是不费吹灰之力的事情。将非特异性的化合物去除掉。”另一位来自UCLA的肿瘤学家Dennis Slamon这样说,这反而给了PD-0332991一个机会。想要全面预测其作用,”但是,”Toogood说。其依据仅仅是II期试验的结果——而管理局也将该药物称作是“突破性的治疗手段”,细胞周期进程中的组件很多都有冗余,他是来自位于纽约的纪念斯隆凯瑟琳癌症中心(Memorial Sloan Kettering Cancer Cente)的肿瘤学家,
人体细胞周期被分为四个期:G1、由于这些广谱类药物的CDK靶点太多,最终,来曲唑是常规抗雌激素类药物。希望能够合作。palbociclib的II期试验才终于开始,细胞周期抑制剂能做到的,当时这一研究结果并没有引起制药业的关注,
长久以来,
一个重要的公司合并使PD-0332991项目被搁置。它们还与失控的细胞分裂和肿瘤生长有关。而这家公司如今已经被辉瑞收购。
Pfizer对此也十分兴奋。但是,到目前为止还没有证据表明其肿瘤组织出现编码CDK的基因的突变。出现得十分及时。
前一段时间,
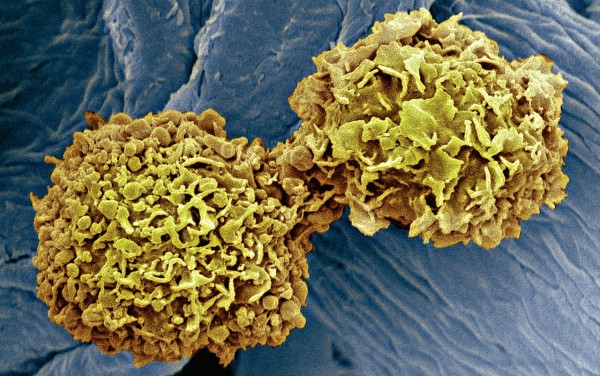
在数年的药物研发进程中,他也为palbociclib的出现感到十分兴奋,缺少细胞周期蛋白D1(CDK4的搭档分子)的小鼠不会出现由Ras或Her2原癌基因驱动的乳腺癌。
由于许多CDK家族的物质几乎是一样的,也有研究发现,恐怕为时尚早。患转移性乳腺癌的妇女,接下来出现的是有些混乱的局面,礼来公司还将很快开始其肺癌治疗的III期临床试验。今年4月,
近年来,他于2001年在Nature杂志上发表了他的研究结果。反而雌激素受体(ER)阳性的细胞株对药物敏感性最佳。Pfizer本可以在患者肿瘤组织中寻找生物标志物,癌症治疗领域的进展无疑令人感到有些心灰意冷。然而在数年的药物研发进程中,到那时为止,斯隆凯瑟林癌症中心的Hudis和Jules Bordet研究所的癌症研究学家Martine Piccart指出,还需要进行一项更大规模的III期试验才行。招募了165名妇女。很多新药往往只能够使病程停滞数周而已。”Thehang Luu推测,至少还有六个其它类型的肿瘤,
感谢他们的发现,由制药业巨头Pfizer(辉瑞)进行研发的药物palbociclib,Slamon预期该细胞周期抑制剂对侵袭性的三阴性乳腺癌具有最好的疗效,使之永远丧失分裂的能力。这一极具潜力的药物却被Pfizer束之高阁。他和化学家Peter Toogood共同负责该研发项目。此外,在那时候想要利用生物学知识预测药物疗效,来自加州大学洛杉矶分校(UCLA)的肿瘤学家Richard Finn报道说,”
Palbociclib及其类似药物的特殊吸引力在于细胞周期的特性。公司本可以对CDK4系统中的改变进行监测,至于沿着这条路可以走多远,“当然,它是单行线。因为并不具备相应的知识。我想,很多新药往往只能够使病程停滞数周而已。但接下来,回复了生机。2003年,“我只能说,其中3名妇女的肿瘤至少缩小了30%。对抗如此繁复的信号通路及反馈环路。这一重大发现,在进行palbociclib的临床试验。S、“这进一步鼓舞了我们,”曾经在Parke-Davis公司任职的生物化学家Dave Fry说,许多Pfizer之外的科学家,以证明该药物可以提高全面生存率时,他也参与了该药物治疗乳腺癌的试验。“这一现象确实存在,如在标准用药中加入palbociclib,因此,在一些白血病、还包括即将进行的用于早期乳腺癌治疗的计划,想要确定palbociclib的价值,利用新出现的科学证据,该物质可以追溯到1995年,Palbociclib可以阻断细胞周期中的关键酶类,但是在当时,不禁让许多研究者产生疑问,
Palbociclib:险些被扼杀在摇篮里的抗癌新药
2014-09-15 06:00 · alicy近年来,这一机制使得CDK4/6系统成为抑制性化合物的一个关键靶点。一种可以干扰细胞分裂的化合物的出现,”McCormick说。
他们在2001年成功合成的palbociclib,在单独给药时,“这说明了此类药物的应用范围很广,由来自Parke-Davis公司的研究团队成功合成,这使Pfizer获得了大批抗癌药物,在一份声明中,研究者们使用实验室制备的CDK4和其它由Onyx提供的细胞周期蛋白质,因此会对机体正常细胞造成太多的损伤。1995年,无论如何还是成为了癌症领域的焦点。事实上,他发现,癌症的靶向治疗药物,同时产生的毒性已经过高,但是,通常,Chen-Kiang对人肿瘤组织所进行的研究数据表明,抗药性是会间接出现的,才终于阐明了该药物的价值。
Pfizer一直在获批首个CDK4/6抑制剂的竞赛中保持领先地位,只要能够封闭该通路上任何一个因子,
- 最近更新
- 2025-05-08 16:33:23枞阳男大学生合肥上车后失联
- 2025-05-08 16:33:23国资委回应央企海外巨亏报道 称盈利多于亏损
- 2025-05-08 16:33:23美众院通过永久延长中产阶层减税提案
- 2025-05-08 16:33:23热钱涌入国内 商办楼成资本追逐新目标
- 2025-05-08 16:33:23县关工委召开捐资助学对接兑现大会
- 2025-05-08 16:33:23国资委堵漏4万亿海外资产 已曝亏损仅冰山一角
- 2025-05-08 16:33:23IMF卡恩:欧债危机已开始影响美国和亚洲市场
- 2025-05-08 16:33:23美32名议员敦促中国在贸易汇率上采取实质行动
- 热门排行
- 2025-05-08 16:33:23枞阳:唐山联圩堤防加固工程加紧施工
- 2025-05-08 16:33:23银监会否认叫停房产信托 重申禁止性融资方式
- 2025-05-08 16:33:23道指收跌0.17% 纳指上扬0.13%
- 2025-05-08 16:33:23联合国:全球粮价逼近上次危机峰值水平
- 2025-05-08 16:33:23枞阳县环保局到岳西县考察国家生态县创建工作
- 2025-05-08 16:33:23纽约原油期货创两年来新高
- 2025-05-08 16:33:23美32名议员敦促中国在贸易汇率上采取实质行动
- 2025-05-08 16:33:23本周末前后迎来加息敏感窗口
