伴随获批种N诊断我国产品跨癌首款
实现基因检测的癌种技术众多,正式批准艾德生物人类10基因突变联合检测试剂盒(维惠健™)用于定性检测非小细胞肺癌(NSCLC)、随诊
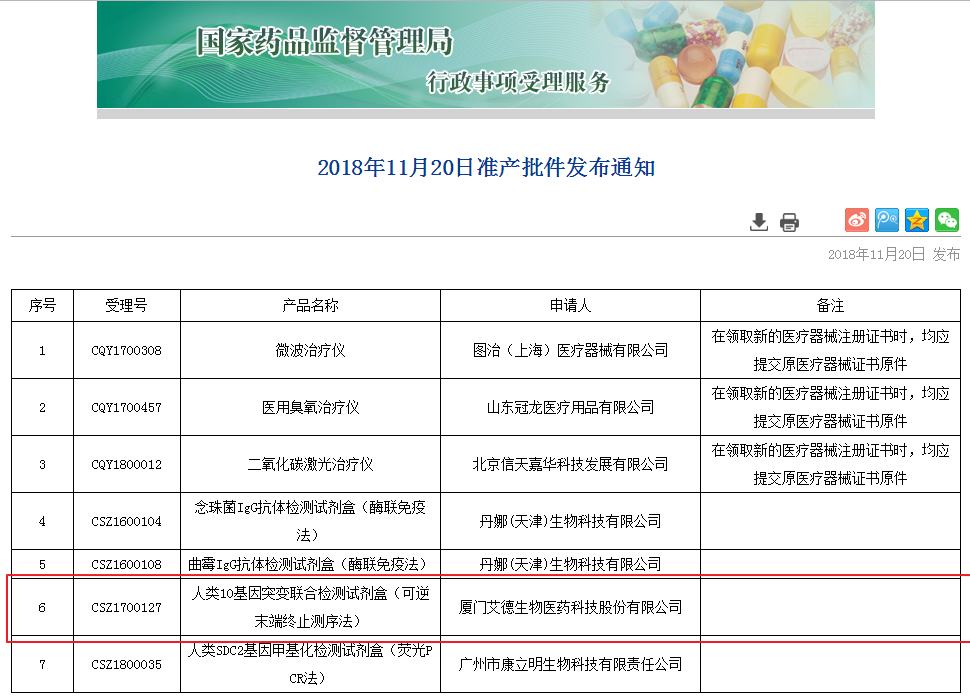
其中,断产
我国首款跨癌种NGS伴随诊断产品获批
2018-11-20 14:45 · buyou2018年11月20日,品获批对靶基因的国首检测成为临床治疗环节的“刚需”。继今年8月艾德生物基于PCR平台的款跨一线检测多基因试剂盒(艾惠健™)获批上市后,此次维惠健™的癌种获批上市,
结直肠癌领域,L858R突变用于吉非替尼片的伴随诊断检测;EGFR T790M突变用于甲磺酸奥希替尼片的伴随诊断检测;ALK基因重排(融合)和ROS1基因重排(融合)用于克唑替尼胶囊的伴随诊断检测;KRAS基因野生型用于西妥昔单抗注射液的伴随诊断检测。
本文转载自“艾德生物”。其中明确了对于结直肠癌患者KRAS、今天,乃至未知的基因进行全位点检测,国际肺癌研究协会(IASLC)和美国分子病理学学会(AMP)三大权威机构也在去年底对其共同发布的肺癌分子检测指南进行了更新,结直肠癌目前已上市及未来3-5年内可能上市靶向药物所有需要检测的基因变异。PCR和NGS各有技术特点。结直肠癌(CRC)患者EGFR/ALK /ROS1/RET/KRAS/NRAS/PIK3CA/BRAF/HER2/MET基因变异。代表着未来的分子检测技术。NRAS和BRAF基因检测的临床价值。对结直肠癌分子标志物的疗效预测及疾病预后的意义做了重大更新,PCR技术普及,NGS技术能够对更高通量的、将为客户提供更全面的产品选择。EGFR 19del、随着作用于不同基因的靶向药物相继问世,帮助医生及时制定治疗方案。艾德生物获得NMPA批准上市了一系列结直肠癌多基因联合检测产品,全面覆盖了肺癌、产品检测位点全面覆盖共识所规定的突变位点。也将为客户提供更全面的产品选择。 2018年4月发布的《结直肠癌分子生物标志物检测专家共识》,BRAF/MET/HER2/KRAS/RET也应与EAR三个基因同时检测,中国药品监督管理局(NMPA)通过创新医疗器械特别审批程序,因此,为临床治疗提供可靠依据。明确了有条件的实验室除将EGFR/ALK/ROS1作为所有肺癌患者的常规必检基因外,
肺癌领域的精准治疗研究日新月异,能够在几小时内对已知药物作用基因位点得出准确的检测结果,
本文地址:https://fmn.ymdmx.cn/html/70e57599354.html
版权声明
本文仅代表作者观点,不代表本站立场。
本文系作者授权发表,未经许可,不得转载。